Семейное право лекции кратко. Понятие и принципы семейного права
Задание 26.
Изотоп никеля-57 образуется при бомбардировке частицами ядер атомов железа-54. Составьте уравнения ядерной реакции и напишите его в сокращенной форме.
Решение:
Изотоп 28-го элемента – никель-57 был получен бомбардировкой
-частицами атомов железа-54. Превращение атомных ядер обуславливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних эле-ментов получить атомы других. Превращение атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнения ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением:
![]()
![]()
Задание 28.
Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
Решение:
Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами (от греч. слов «изос»
- одинаковый и «топос»
- место). Установлено, что, как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин. Так, природный хлор на 75,53% состоит из изотопа 35Cl и на 24,47% из изотопа 37Cl; в результате средняя атомная масса хлора равна 35,453.
В природе встречается и другое явление, заключающееся в том, что атомы разных элементов обладают одинаковой атомной массой, но разным зарядом ядер. Такие атомы называют изобарами. Например, изотоп калия и изотоп кальция имеют одинаковые атомные массы (40), но разные заряды ядер Соответственно +19 и +20:

Задание 29.
Изотоп кремния-30 образуется при бомбардировке -частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение:
![]()
Часто применяют сокращённую форму записи ядерной реакции. Для данной реакции она будет иметь вид:
В скобках пишут бомбардирующую частицу, а через запятую – частицу, образующуюся при данном ядерном процессе. В сокращённых уравнениях частицы
обозначают соответственно , p, d, n, е.
Задание 31.
Изотоп углерода- 11 образуется при бомбардировке протонами ядер атомов азота- 14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение:
Превращение атомных ядер обуславливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других. Превращение атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнения ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением:
Часто применяют сокращённую форму записи ядерной реакции. Для данной реакции она будет иметь вид:
В скобках пишут бомбардирующую частицу, а через запятую – частицу, образующуюся при данном ядерном процессе. В сокращённых уравнениях частицы
обозначают соответственно , p, d, n, е.
Задание 328
Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
Решение:
Для водорода известны три изотопа: - протий Н
, - дейтерий D
, - тритий Т
. Протий и дейтерий встречаются в природе, тритий получен искусственно. Ядро протия состоит из одного протона, ядро дейтерия - из одного протона и одного нейтрона, а ядро трития – из одного протона и двух нейтронов.
Тяжёлая вода D 2 O – соединение дейтерия с кислородом. Тяжёлую воду получают путём электролиза природной воды. При электролизе воды разряд ионов Н + происходит значительно быстрее, чем D + , поэтому в остатке после разложения электролизом большого количества воды концентрируется D 2 O.
Тяжёлая вода D 2 O по физико-химическим свойствам отличается от Н 2 О: t пл. = 3,82 0С, t кип . = 101,42 0 С, р плот, равна 1,1050 г/см 3 (20 0 C). Заметно различаются энтальпии растворения солей в Н 2 O и D 2 O, константы диссоциации кислот и другие характеристики растворов.
Тема 1. ФИЗИЧЕСКИЕ ОСНОВЫ РАДИОЭКОЛОГИИ
Лекция 2: Физическая характеристика атомов и радиоактивный распад ядер.
Строение атома. Элементарные частицы. Виды радиоактивного распада. Закон радиоактивного распада.
1. Строение атома.
Атом – мельчайшая частица химического элемента, сохраняющая все его свойства. По своей структуре атом (размер примерно 10-8см) представляет сложную систему, состоящую из находящегося в центре атома положительно заряженного ядра (10-13см) и отрицательно заряженных электронов, вращающихся вокруг ядра на различных орбитах. Радиус атома равен радиусу орбиты самого удаленного от ядра электрона . Отрицательный заряд электронов равен положительному заряду ядра, при этом атом в целом электрически нейтрален.
В 1911 году Э. Резерфорд предложил планетарную модель строения атома, которая была развита Н. Бором (1913). Согласно этой модели в центре атома расположено ядро, имеющее положительный электрический заряд. Вокруг ядра перемещаются по эллиптическим орбитам электроны, образующие электронную оболочку атома.
Любой атом состоит из элементарных частиц: протонов, нейтронов и электронов, которые в свободном состоянии характеризуются такими физическими величинами, как масса, электрический заряд (или его отсутствие), устойчивость, скорость т. д. Массу ядер и элементарных частиц обычно выражают в атомных единицах массы (а. е.м.), за единицу принята 1\12массы атомы углерода (12С).
1 а. е.м. = 1,67*10-27 кг
Энергия выражается в электрон-вольтах (эВ), один электрон-вольт равен кинетической энергии, которую приобретает электрон (или любая элементарная частица вещества, имеющая заряд) при прохождении электрического поля с разностью потенциалов в один вольт.
1эВ = 1,602*10-19Кл
Кроме этого массу часто выражают в энергетических эквивалентах (это энергия покоя частицы, масса которой равна 1 а. е.м., составляет 931,5МэВ (106 эВ).
Атомное ядро – центральная часть атома, в которой сосредоточена почти вся масса (99,9%). Атомное ядро состоит из двух типов элементарных частиц – протонов и нейтронов. Общее название их – нуклон . Протон и электрон относятся к так называемым устойчивым и стабильным частицам, нейтрон стабилен, лишь находясь в ядре.
Суммарное число протонов и нейтронов в ядре называют массовым числом и обозначают буквой А (или М). Так как заряд нейтрона равен нулю, а протон имеет элементарный положительный заряд +1, то заряд ядра равен числу находящихся в нем протонов, которое называется зарядовым числом (Z) или атомным номером . Число нейтронов в ядре равно разности между массовым А числом и атомным номером Z элемента: N = A-Z (АZX).
Электрический заряд (q) ядра равен произведению элементарного электрического заряда (е) на атомный номер (Z) химического элемента периодической системы:
Ядерные силы.
Протоны и нейтроны внутри атомного ядра удерживаются ядерными силами . Ядерные силы составляют потенциальную энергию связи ядра. Установлено, что сумма энергий свободных протонов и нейтронов больше энергии составленного из них ядра, из чего следует, что для разделения ядра на его составляющие нужно затратить энергию. Минимальная энергия, необходимая для этого называется энергией связи ядра .
Такая же картина наблюдается, если сложить массы нуклонов, составляющих ядро атома. Расчетная масса ядра окажется больше фактической масса ядра. Разницу между расчетной и фактической массой ядра называют дефектом массы.
Ядерные силы не зависят от наличия или отсутствия электрического заряда у нуклонов, действуют только на очень малых расстояниях (10-13см) и с увеличением расстояния между ядерными частицами очень быстро ослабевают.
Для ядерных сил характерно свойство насыщения, которое заключается в том, что нуклон оказывается способным к ядерному взаимодействию одновременно только с незначительным числом соседних нуклон, что указывает на возможную природу ядерных сил, как сил обменного типа.
Основные свойства ядерных сил объясняются тем, что нуклоны обмениваются между собой частицами массой немногим более 200 электронных масс (X. Юкава, 1935г), такие частицы обнаружены экспериментально (1947) и названы π-мезонами или пионами (существуют положительные, отрицательные и нейтральные π-мезоны). Мезоны не являются составными частями протонов и нейтронов, а испускаются и поглощаются ими (подобно тому, как атомы испускают и поглощают кванты электромагнитного излучения), при этом протон, испустивший положительный пион, превращается в нейтрон, а нейтрон после захвата пиона превращается в протон. Все эти процессы обеспечивают сильное взаимодействие и тем самым устойчивость ядер.
Протон (р) – элементарная частица, входящая в состав любого атомного ядра, имеющая положительный заряд равный единичному элементарному заряду +1 (1,602*10-19Кл). Масса покоя протона составляет 1,00758 а. е.м. или 938,27 МэВ.
Число протонов в ядре (атомный номер ) для каждого элемента строго постоянно и соответствует порядковому номеру элемента (Z) таблицы. Так как каждый протон имеет положительный элементарный заряд электричества, то атомный номер элемента показывает и число положительных элементарных зарядов в ядре любого атома химического элемента. Порядковый номер элемента еще называют зарядовым числом. Число протонов в ядре определяет число электронов в оболочке атома (но не наоборот) и соответственно строение электронных оболочек и химические свойства элементов.
Нейтрон ( n) – электрически нейтральная элементарная частица (отсутствует лишь в ядре легкого водорода), масса покоя которой равна 1,00898 а. е.м. или 939,57 МэВ. Масса нейтрона больше массы протона на две электронные массы. В атомном ядре нейтроны являются стабильными, их число (N) в ядре атома одного и того же элемента может колебаться, что дает в основном только физическую характеристику элемента (1).
Электрон – стабильная элементарная частица, имеющая массу покоя, равной 0,000548 а. е.м., а в абсолютных единицах массы - 9,1*10-28кг. Энергетический эквивалент а. е.м. электрона равен 0,511 МэВ и элементарный электрический заряд – 1,602*10-19Кл.
Электроны двигаются вокруг ядра по орбиталям определенной формы и радиуса. Орбиты группируются в электронные слои (максимально может быть семь: K, L, M, N, O, P, Q). Наименьшее число электронов, которое может находиться на орбиталях одного слоя, определяется квантовым соотношением:
m=2 n2 ,
где n – главное квантовое число (в данном случае совпадает с номером слоя. Следовательно в К-слое (n=1) может находиться 2 электрона, в L-слое (n=2) – 8 электронов и так далее.
Основную роль во взаимодействии электронов с атомным ядром играют электромагнитные силы (силы кулоновского притяжения разноименных электрических зарядов). Чем ближе к ядру находится электрон, тем больше его потенциальная энергия (энергия связи с ядром) и меньше кинетическая энергия (энергия вращения электрона). Соответственно электроны с внешней орбиты (энергия связи около 1-2 эВ) сорвать легче, чем с внутренней.
Переход отдельного электрона с орбиты на орбиту всегда связан с поглощением или высвобождением энергии (поглощается или испускается квант энергии). Согласно постулатам Бора атомная система находится в стационарном состоянии, которое характеризуется определенной энергией. Бесконечно долго каждый атом может находиться только в стационарном состоянии с минимальной энергией, которое называется основным или нормальным . Все остальные стационарные состояния атома с большими энергиями называются возбужденными . Переход электрона с одного энергетического уровня на другой, более удаленный от ядра (с большей энергией) называется процессом возбуждения .
В результате соударения с другими атомами, с любой заряженной частицей или при поглощении фотона электромагнитного излучения атом может перейти из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Время жизни атома в возбужденном состоянии не превышает с. Из любого возбужденного состояния атом самопроизвольно переходит в основное состояние, этот процесс сопровождается излучением фотонов (квантов). В зависимости от разности энергий атома в двух состояниях, между которыми совершается переход, испускаемый квант электромагнитного излучения может принадлежать диапазону радиоволн, инфракрасного излучения, видимого света, ультрафиолетового или рентгеновского излучения.
При сильных электрических воздействиях электроны могут вырываться за пределы атома. Атом, лишившийся одного или нескольких электронов, превращается в положительный ион, а присоединивший к себе один или несколько электронов – в отрицательный. Процесс образования ионов из нейтральных атомов называется ионизацией . В обычных условиях атом в состоянии иона существует очень короткое время. Свободное место на орбите положительного иона заполняется свободным электроном, и атом вновь становится электрически нейтральной системой. Этот процесс носит название рекомбинации ионов (деионизации) и сопровождается выделением избыточной энергии в виде излучения.
Изотопы, изотоны, изобары.
Атомы, имеющие ядра с одинаковым числом протонов, но различающиеся по числу нейтронов, являются разновидностями одного и того же химического элемента и называются изотопами . Такие элементы имеют одинаковый номер в таблице, но разное массовое число (3919К, 4019К, 4119К). Поскольку заряды ядер этих атомов одинаковые, элементарные оболочки их имеют почти однотипное строение, а атомы с такими ядрами чрезвычайно близки по химическим свойствам. Большинство химических элементов в природе представляет собой смесь изотопов. Обычно в смеси изотопов одного определенного элемента преобладает один изотоп, а остальные составляют только небольшой процент (например, калий состоит из: 39К – 93,08%; 40К – 0,0119%; 41К – 6,91%) (4).
Чтобы отличить изотопы одного химического элемента друг от друга, перед названием элемента сверху приписывают массовое число, равное сумме всех частиц ядра данного изотопа, а снизу – заряд ядра (число протонов), соответствующий порядковому номеру элемента в таблице. Так, наиболее распространенный в природе легкий водород 11Н (протий) содержит 1 протон, редко встречающийся среди атомов водорода 21Н (дейтерий) -1 протон и 1 нейтрон, а никогда не встречающийся в природе 31Н (тритий) – 1 протон и 2 нейтрона (тритий получают искусственным путем, облучая дейтерий медленными нейтронами) (4).
Различают стабильные и нестабильные (радиоактивные ) изотопы . К первым относятся такие изотопы, ядра которых при отсутствии внешних воздействий не претерпевают никаких превращений, ко вторым – изотопы, ядра которых могут самопроизвольно (без внешнего воздействия) распадаться, образуя при этом ядра атомов других элементов. Ядра всех изотопов химических элементов принято называть нуклидами, нестабильные нуклиды называются радионуклидами . В настоящее время известно около 300 стабильных изотопов и около 1500 радиоактивных.
Условие устойчивости атомных ядер: устойчивыми являются лишь те из атомных ядер, которые обладают минимальной энергией по сравнению со всеми ядрами, в которые данное ядро могло бы самопроизвольно превратиться.
Атомные ядра разных элементов с равным числом нейтронов называют изотонами . Например 136С имеет шесть протонов и семь нейтронов, 147N имеетсемь протонов и тоже семь нейтронов.
Атомные ядра, разных элементов с одинаковым массовым числом, но с разным атомным номером (т. е. состоящие из одинакового числа нуклонов при разном соотношении протонов и нейтронов) называются изобарами .
Например: 104Be, 105B, 106C и т. д.
Различие в энергии атомных ядер изобаров определяется наличием у протонов электрического заряда и существованием различия в массах протона и нейтрона. Так ядра, содержащие значительно больше протонов, чем нейтронов, оказываются нестабильными, так как обладают избытком энергии кулоновского взаимодействия. Ядра же, имеющие больше нейтронов, чем протонов, нестабильны из-за того, что масса нейтрона больше массы протона, а увеличение массы ядра приводит к увеличению его энергии. От избыточной энергии ядра могут освобождаться двумя путями:
1. путем самопроизвольного деления ядер на более устойчивые части;
2. путем самопроизвольного изменения заряда ядра на единицу (превращение протоны в нейтрон или нейтрона в протон).
Элементарные частицы.
Элементарные частицы не являются молекулами, атомами или ядрами. Они имеют радиус (R) равный 10-14 – 10-15м и энергию (W) около 106 – 108 эВ. Сейчас общее число известных элементарных частиц (вместе с античастицами) приближается к 400. Некоторые из них стабильны или квазистабильны и существуют в природе в свободном или слабосвязанном состоянии. Это электроны , входящие в состав атомов, их античастицы – позитроны ; протоны и нейтроны , входящие в состав атомных ядер; фотоны γ, являющиеся квантами электромагнитного поля. Сюда же можно отнести электронные (анти)нейтрино νе, рождающиеся в процессах бета-превращений и в термоядерных реакциях, протекающих в звездах. Все остальные элементарные частицы крайне нестабильны и образуются во вторичном космическом излучении или получаются в лаборатории. К ним относятся мюоны (мю-мезоны) μ– – тяжелый аналог электрона (mμ ≈ 200mе) зарегистрированы в космических лучах; пионы (пи-мезоны) π+, π0, π– – переносчики ядерного взаимодействия и другие.
У каждой частицы имеется античастица, обычно обозначаемая тем же символом, но с добавлением «тильды» над ним. Массы, время жизни и спины частицы и античастицы одинаковы. Остальные характеристики, в том числе электрический заряд и магнитный момент, равны по модулю, но противоположны по знаку.
2. Виды радиоактивного распада.
Радиоактивность – это свойство атомных ядер определенных химических элементов самопроизвольно превращаться в ядра других элементов с испусканием особого рода излучения, называемого радиоактивным излучением . Само явление носит название радиоактивный распад .
Радиоактивные превращения, происходящие в природе, называются естественной радиоактивностью. Аналогичные процессы, происходящие в искусственно полученных веществах (через соответствующие ядерные реакции), - искусственной радиоактивностью. Оба вида радиоактивности подчиняются одним и тем же законам.
Существуют следующие типы ядерных превращений, или видов радиоактивного распада: альфа-распад, бета-распад (электронный, позитронный), электронный захват (К-захват), внутренняя конверсия, деление ядер.
Альфа-распад – это самопроизвольное деление неустойчивого атомного ядра на α-частицу (ядро атома гелия 42Не) и ядро-продукт (дочернее ядро).При этом заряд ядра продукта уменьшается на 2 положительные единицы, а массовое число на 4 единицы. При этом образующийся элемент-продукт смещается влево относительно исходного на две клетки периодической системы:
Альфа-радиоактивными являются практически все (за редким исключением) ядра атомов элементов с порядковым номером 82 и больше (те, что в периодической таблице стоят за свинцом 82Pb). Альфа-частица, вылетая из ядра, приобретает кинетическую энергию порядка 4-9 МэВ.
Бета-распад – это самопроизвольное превращение нестабильных атомных ядер с испусканием β-частицы, при котором их заряд изменяется на единицу. В основе этого процесса лежит способность протонов и нейтронов к взаимным превращениям.
Если в ядре имеется излишек нейтронов («нейтронная перегрузка» ядра), то происходит электронный β- - распад , при котором один из нейтронов превращается в протон, а ядро испускает электрон и антинейтрино (массовое и зарядовое число которой равно 0).
10n → 11p + e – + ν – || AZX → AZ+1Y + β – + ν – +Q || 4019K → 4020Ca + β – + ν – + Q.
При этом распаде заряд ядра и соответственно атомный номер элемента увеличиваются на единицу (элемент сдвигается в периодической системе на один номер вправо от исходного), а массовое число остается без изменений. Электронный бета-распад характерен для многих естественных и искусственно полученных радиоактивных элементов.
Если неблагоприятное соотношение нейтронов и протонов в ядре обусловлено излишком протонов, то происходит позитронный (β+ ) распад , при котором ядро испускает позитрон (частицу такой же массы, как и электрон, но имеющую заряд +1) и нейтрино, а один из протонов превращается в нейтрон:
11p → 10n + e+ + ν+ || AZX → AZ-1Y + β+ + ν+ +Q || 3015P → 3014Si + β+ + ν+ +Q
Заряд ядра и соответственно атомный номер элемента уменьшаются на единицу, и дочерний элемент будет занимать место в периодической системе на один номер левее от исходного, массовое число остается без изменения. Позитронный распад наблюдается у некоторых искусственно полученных изотопов.
Позитрон, вылетев из ядра, срывает с оболочки атома «лишний» электрон или взаимодействует со свободным электроном, образуя пару «позитрон-электрон», которая мгновенно превращается в два гамма-кванта с энергией, эквивалентной массе частиц (е+ и е-) по 0,511 МэВ. Процесс превращения пары «позитрон-электрон» в два γ-кванта получил название аннигиляции (уничтожения), а возникающее электромагнитное излучение – аннигиляционное . Таким образом, при позитронном распаде за пределы материнского атома влетают не частицы, а два гамма-кванта с энергией 0,511 МэВ.
Энергетический спектр β-частиц любого бета-источника является непрерывным (от сотых долей МэВ – мягкое излучение, до 2-3 МэВ – жесткое).
Электронный захват – самопроизвольное превращение атомного ядра, при котором его заряд уменьшается на единицу за счет захвата одного из орбитальных электронов и превращения протона в нейтрон.
Это происходит, если в ядре имеется излишек протонов, но недостаточно энергии для позитронного распада. Один из протонов ядра захватывает электрон с одной из оболочек атома, чаще всего с ближайшего к нему К-слоя (К-захват) или реже L-слоя (L-захват) и превращается в нейтрон с испусканием нейтрино. При этом дочерний элемент, как и при позитронном распаде, смещается в периодической системе на одну клетку влево от исходного.
11p + 0-1е → 10n + ν+ || AZX + 0-1е → AZ-1Y + ν+ + hν || 12352Te + 0-1е → 12351Sb + ν+ + hν
На освободившееся место в К-слое перескакивает электрон с L-слоя, на место последнего со следующего слоя и т. д. Каждый переход электрона со слоя на слой сопровождается выделением энергии в виде квантов электромагнитного излучения (рентгеновского диапазона).
Позитронный распад и электронных захват, как правило, наблюдают только у искусственно-радиоактивных изотопов (4).
Деление ядер – это спонтанное деление ядра, при котором оно, без какого либо внешнего воздействия, распадается на две, как правило, неравные части. Так ядро урана может делиться на ядра бария (56Ва) и криптона (36Kr). Этот тип распада характерен для изотопов элементов стоящих в периодической системе за ураном. Под действием сил электростатического отталкивания одноименных зарядов ядра-осколки приобретают кинетическую энергию порядка 165 МэВ и разлетаются в разные стороны с огромными скоростями.
Внутренняя конверсия . Возбужденное ядро передает энергию возбуждения одному из электронов внутренних слоев (К-, L-, или М-слой), который в результате этого вырывается за пределы атома. Затем один из электронов с более отдаленных слоев (с более высоких энергетических уровней) осуществляет квантовый переход на «вакантное» место с испусканием характеристического рентгеновского излучения.
3. Закон радиоактивного распада.
Количество любого радиоактивного изотопа со временем уменьшается вследствие радиоактивного распада (превращения ядер). Радиоактивный распад идет непрерывно, скорость этого процесса и его характер определяются строением ядра. Поэтому на этот процесс нельзя повлиять никакими обычными физическими или химическими способами, не изменив состояния атомного ядра. Кроме того, распад носит вероятностных характер, то есть нельзя точно определить, когда и какой именно атом распадется, но в каждый промежуток времени распадается в среднем какая то определенная часть атомов.
Для каждого радиоактивного изотопа средняя скорость распада его атомов постоянна, неизменна и характерна только для данного изотопа. Постоянная радиоактивного распада λ для определенного изотопа показывает, какая доля ядер распадется в единицу времени. Постоянную распада выражают в обратных единицах времени с-1, мин-1, ч-1 и т. д., чтобы показать, что количество радиоактивных ядер со временем убывает, а не растет.
Самопроизвольное превращение ядер любого радиоактивного изотопа подчиняется закону радиоактивного распада, который устанавливает, что за единицу времени распадается одна и та же доля имеющихся в наличии ядер.
Математическое выражение этого закона, описывающее процесс убывания количества радиоактивных ядер со временем, отображается следующей формулой:
Nt = N0e-λ t , (Nt = N0e-0,693t/Т ) (1),
где, Nt – число радиоактивных ядер, оставшихся по прошествии времени;
N0 – исходное число радиоактивных ядер в момент времени t=0;
λ – постоянная радиоактивного распада (=0,693/Т);
Т – период полураспада данного радиоизотопа.
Для характеристики скорости распада радиоактивных элементов на практике пользуются периодом полураспада.
Период полураспада – это время, в течение которого распадается половина исходного количества радиоактивных ядер. Он обозначается буквой Т и выражается в единицах времени.
Для различных радиоактивных изотопов период полураспада имеет значения от долей секунды до миллионов лет. Причем у одного и того же элемента могут быть изотопы с различным периодом полураспада. Соответственно и радиоактивные элементы разделяются на короткоживущие (часы, дни) – 13153I (8,05 суток), 21484Po (1,64*10-4сек.) и долгоживущие (годы) – 23892U (T=4.47 млрд. лет), 13755Cs (30 лет), 9038Sr (29 лет).
Между периодом полураспада и постоянной распада существует обратная зависимость, т. е. чем больше λ, тем меньше Т, и наоборот.
Графически закон радиоактивного распада выражается экспоненциальной кривой (Рис. 2.1.). Как видно из рисунка, с увеличением числа периодов полураспада число нераспавшихся атомов убывает, постепенно приближаюсь к нулю [ и др., 1999].
Рис. 2.1. Графическое изображение закона радиоактивного распада.
Активность радиоактивного элемента равна числу распадов в единицу времени. Чем больше радиоактивных превращений испытывают атомы данного вещества, тем выше его активность. Как следует из закона радиоактивного распада, активность радионуклида пропорциональна числу радиоактивных атомов, т. е. возрастает с увеличением количества данного вещества. Поскольку скорость распада радиоактивных изотопов различна, то одинаковые по массе количества различных радионуклидов имеют разную активность.
В системе СИ единицей активности является беккерель (Бк) – распад в секунду (расп/с). Наряду с Бк используется внесистемная единица – кюри (Ки). 1Ки – это активность любого радиоактивного вещества (изотопа) в котором происходит 3,7*1010 актов распада в секунду. Единица кюри соответствует радиоактивности 1 г радия.
1Ки = 3,7*1010 Бк; 1мКи = 37МБк 1мкКи = 37 кБк
Активность любого радиоактивного препарата по истечении времени t определяют по формуле, соответствующей основному закону радиоактивного распада:
At = A0е-0,693 t/Т (2),
где At – активность препарата через время t;
А0 – исходная активность препарата;
е – основание натуральных логарифмов (е=2,72);
t – время, в течение которого распадался радиоизотоп;
Т – период полураспада; значения Т и t должны иметь одинаковую размерность (мин., сек., часы, дни и т. д.).
(Пример: Активность А0 радиоактивного элемента 32Р на определенный день равна 5 мКи. Определить активность этого элемента через неделю. Период полураспада Т элемента 32Р составляет 14,3 дня. Активность 32Р через 7 суток. At = 5 * 2,720,693*7/14,3 = 5 * 2,720,34 = 3,55 мКи).
Единицы кюри (Ки) для характеристики гамма-активности источников непригодны. Для этих целей введена другая единица – эквивалент 1 мг радия (мг-экв. радия). Миллиграмм-эквивалент радия – это активность любого радиоактивного препарата, гамма-излучение которого при идентичных условиях измерения создает такую же мощность экспозиционной дозы, как гамма-излучение 1 мг радия Государственного эталона радия РФ при использовании платинового фильтра толщиной 0,5 мм. Единица миллиграмм-эквивалент радия не установлена существующими стандартами, но широко используется на практике.
Точечный источник в 1мг (1мКи) радия, находящийся в равновесии с продуктами распада, после начальной фильтрации через платиновую пластину толщиной 0,5 мм создает в воздухе на расстоянии 1см мощность дозы 8,4 Р/ч. Эту величину называют ионизационной гамма-постоянной радия и обозначают буквой Кγ . Гамма-постоянная радия принята за эталон мощности дозы излучания. С ней сравнивают Кγ всех других гамма-излучателей. Существуют таблицы гамма-постоянных для большинства радиоактивных изотопов.
Так, гамма-постоянная 60Со составляет 13,5 Р/ч. Сравнение гамма-постоянных радия и 60Со показывает, что 1 мКи радионуклида 60Со создает дозу излучения, в 1,6 раза большую, чем 1 мКи радия (13,5/8,4=1,6). Иначе говоря, по создаваемой дозе излучения в воздухе 1 мКи радионуклида 60Со эквивалентен 1,6 мКи радия, т. е. гамма-излучение, испускаемое препаратом 60Со активностью 0,625 мКи, создает такую же дозу излучения, что и 1 мКи радия.
Гамма-эквивалент М изотопа связан с его активностью А (мКи) через ионизационную гамма-постоянную Кγ соотношениями:
М = АКγ/8,4 или А = 8,4М/Кγ (3),
которые позволяют перейти от активности радиоактивного вещества, выраженной в мг-экв. радия, к активности, выраженной в мКи и наоборот.
Согласно протонно-нейтронной теории ядер, изотопами называют разновидности атомов с одинаковым числом протонов и различным числом нейтронов в ядрах; изобарами - разновидности атомов с различным числом протонов и нейтронов, но одинаковым числом нуклонов. (Такие атомы следовало бы, по предложению С. А. Щукарева, называть изонуклонами, так как при одинаковом массовом числе истинные массы двух изобаров не равны друг другу.)
В 1906 г. были открыты первые радиоактивные изотопы 230 90 Тh и 232 90 Тh, в 1919 г. удалось экспериментально доказать наличие устойчивых изотопов у неона - 20 10 Ne и 22 10 Ne. С каждым годом число открытых изотопов возрастало: в 1921 г. их было известно уже 243, а в настоящее время - свыше 1500 (из которых только 272 являются устойчивыми или стабильными изотопами).
В соответствии с числом протонов, входящих в состав ядра, все элементы можно разделить на четные и нечетные по Z (Z чет и Z нечет). Так как в состав ядер входят также нейтроны, а число их равно или больше числа протонов, т. е. оно может быть также четным или нечетным, то, следовательно, и массовые числа А(= Z + N) могут принимать четные и нечетные значения. Отсюда следует, что возможны четыре варианта ядер атомов:
Так возникло представление о четных типах ядер. Оказалось, что наиболее устойчивыми являются ядра с Z4eT и особенно те, для которых Z чет и А чет - это так называемые четно-четные ядра (с четным Z и четным N). Менее прочными являются ядра с A нечет. Это четно-нечетные ядра (с четным Z и нечетным N) и нечетно-четные (с нечетным Z и четным N). Наименьшей прочностью обладают нечетно-нечетные ядра (с нечетным Z и нечетным N). Известно всего 4 устойчивых нечетно-нечетных ядра: 2 1 Н, 6 3 Li, 10 5 B и 14 7 N.
Из 42 нечетных по Z элементов (до 83-го включительно) два не имеют устойчивых изотопов (43 Тс, 61 Pm), четырнадцать имеют по два устойчивых изотопа, а все остальные - только по одному устойчивому изотопу, причем все устойчивые изотопы характеризуются нечетным массовым числом, кроме четырех изотопов: 2 Н, 6 Li, 10 B и 14 N. Таким образом, нечетные Z элементы являются в основном моноизотопными, состоящими из одного устойчивого изотопа.
Для 41 четного по Z элемента (до 82) известно 213 устойчивых изотопа, причем только один элемент моноизотопен (9 Ве), а все остальные - полиизотопны и имеют от 2 до 10 изотопов (например, у 50 Sn десять устойчивых изотопов с А = 112 ÷ 124). Элементы с четным А имеют 162 устойчивых изотопа, с нечетным - 51.
Устойчивость изотопов определяется отношением квадрата порядкового номера к массовому числу Z 2 /A. Если (Z 2 /A) > 33, то у элемента нет ни одного устойчивого изотопа. Таковыми являются элементы с Z = 84 ÷ 105; у них все изотопы радиоактивны. Последний элемент, для которого еще известен устойчивый изотоп, - это элемент с Z = 83, т. е. висмут - 209 83 Вi.
Для каждого отдельного элемента существует оптимальное отношение числа нейтронов к числу протонов
при котором возможно существование устойчивых изотопов: за пределами этого отношения при избытке протонов и недостатке нейтронов известны β + -радиоактивные изотопы, а при избытке нейтронов и недостатке протонов - β - -радиоактивные изотопы. Например, для кислорода известны семь изотопов:

Природный кислород представляет собой смесь - плеяду из трех устойчивых изотопов: 16 8 O (99,759%), 17 8 O (0,037%) и 18 8 O (0,204%), в которой больше всего легкого изотопа, содержащего в ядре равное число нейтронов и протонов: Σn / Σр = 8:8 = 1. Это отношение является характерным для наиболее устойчивых изотопов всех четных по Z элементов до 40 20 Са включительно. В ядрах изотопов последующих элементов с Z = 21 ÷ 83 в связи с возрастающим числом протонов электростатические силы отталкивания между ними увеличиваются, и ядра стабилизируются за счет "вхождения" большего числа нейтронов. Отношение Σn / Σр постепенно растет, доходя у 209 83 Вi до 1,518.
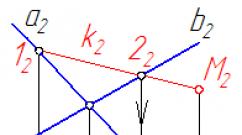
Из диаграммы устойчивости ядер всех изотопов (рис. 18), составленной в координатах Z - N, видно, что легкие ядра до 40 20 Са группируются вдоль прямой линии N = Z, отвечающей отношению Σn / Σр = 1. Для последующих ядер это отношение возрастает вследствие увеличения числа нейтронов, но остается меньше 2 (прямая N = 2Z). В вертикальном направлении расположены изотопы элементов: черными кружками обозначены - устойчивые, белыми кружками - β - - и β +3 радиоактивные.
) A = N + Z в ядрах-изобарах одинаково, числа протонов Z и нейтронов N различаются: , . Совокупность нуклидов с одинаковым A , но разным Z называют изобарической цепочкой. В то время как массовое число изобаров одинаково, их атомные массы совпадают лишь приближённо. Зависимость атомной массы (или избытка массы) от Z в изобарической цепочке показывает направление возможных бета-распадов . Эта зависимость в первом приближении представляет собой параболу (см. формула Вайцзеккера) - сечение долины стабильности плоскостью A = const .
Примордиальные изобарные пары и триады
Существуют 59 примордиальных изобарных пар и 9 примордиальных изобарных триад, которые в основном включают в себя стабильные изотопы элементов с чётными Z, отличающимися на 2 единицы. Если учитывать только стабильные нуклиды, то существуют 48 изобарных пар и 1 изобарная триада:
Примордиальные изобарные пары
| № | Массовое число | Изобарная пара | № | Массовое число | Изобарная пара | № | Массовое число | Изобарная пара |
|---|---|---|---|---|---|---|---|---|
| 1 | 36 | 21 | 104 | 41 | 150 | (2β −) | ||
| 2 | 46 | 22 | 106 | 42 | 152 | (α) | ||
| 3 | 48 | (2β −) | 23 | 108 | 43 | 154 | ||
| 4 | 54 | 24 | 110 | 44 | 156 | |||
| 5 | 58 | 25 | 112 | 45 | 158 | |||
| 6 | 64 | 26 | 113 | (β −) | 46 | 160 | ||
| 7 | 70 | 27 | 114 | 47 | 162 | |||
| 8 | 74 | 28 | 115 | (β −) | 48 | 164 | ||
| 9 | 76 | (2β −) | 29 | 116 | (2β −) | 49 | 168 | |
| 10 | 78 | 30 | 120 | 50 | 170 | |||
| 11 | 80 | 31 | 122 | 51 | 174 | (α) | ||
| 12 | 82 | (2β −) | 32 | 123 | 52 | 184 | ||
| 13 | 84 | 33 | 126 | 53 | 186 | (α) | ||
| 14 | 86 | 34 | 128 | (2β −) | 54 | 187 | (β − , α) | |
| 15 | 87 | (β −) | 35 | 132 | 55 | 190 | (α) | |
| 16 | 92 | 36 | 134 | 56 | 192 | |||
| 17 | 94 | 37 | 142 | 57 | 196 | |||
| 18 | 98 | 38 | 144 | (α) | 58 | 198 | ||
| 19 | 100 | (2β −) | 39 | 146 | (α) | 59 | 204 | |
| 20 | 102 | 40 | 148 | (α) |
| № | Массовое число | Изобарная триада |
|---|---|---|
| 1 | 40 | (β + , β − , ε) |
| 2 | 50 | (β + , β −) |
| 3 | 96 | (2β −) |
| 4 | 124 | |
| 5 | 130 | (2β −) (2ε) |
| 6 | 136 | (2β −) |
| 7 | 138 | (ε, β −) |
| 8 | 176 | (β −) |
| 9 | 180 | (изомер) (α) |
В масс-спектрометрии
В масс-спектрометрии изобарами называются как ядра с одинаковым массовым числом, так и молекулы с (приблизительно) одинаковой молекулярной массой. Так, молекулы 16 O 1 H 2 H (полутяжёлой воды) являются молекулярными изобарами к атому 19 F . Ионы таких молекул и атомов имеют почти одинаковое отношение масса/заряд (при равном заряде) и, следовательно, движутся в электромагнитных полях масс-спектрометра по почти одинаковой траектории, являясь источником фона для своих изобар.
См. также
Напишите отзыв о статье "Изобары"
Примечания
Литература
- Б. М. Яворский, А. А. Детлаф, А. К. Лебедев. Справочник по физике. - М .: «ОНИКС», «Мир и Образование», 2006. - 1056 с. - 7 000 экз. - ISBN 5-488-00330-4 .
Отрывок, характеризующий Изобары
– Нездорова, что ли? От страха министра, как нынче этот болван Алпатыч сказал.– Нет, mon pere. [батюшка.]
Как ни неудачно попала m lle Bourienne на предмет разговора, она не остановилась и болтала об оранжереях, о красоте нового распустившегося цветка, и князь после супа смягчился.
После обеда он прошел к невестке. Маленькая княгиня сидела за маленьким столиком и болтала с Машей, горничной. Она побледнела, увидав свекора.
Маленькая княгиня очень переменилась. Она скорее была дурна, нежели хороша, теперь. Щеки опустились, губа поднялась кверху, глаза были обтянуты книзу.
– Да, тяжесть какая то, – отвечала она на вопрос князя, что она чувствует.
– Не нужно ли чего?
– Нет, merci, mon pere. [благодарю, батюшка.]
– Ну, хорошо, хорошо.
Он вышел и дошел до официантской. Алпатыч, нагнув голову, стоял в официантской.
– Закидана дорога?
– Закидана, ваше сиятельство; простите, ради Бога, по одной глупости.
Князь перебил его и засмеялся своим неестественным смехом.
– Ну, хорошо, хорошо.
Он протянул руку, которую поцеловал Алпатыч, и прошел в кабинет.
Вечером приехал князь Василий. Его встретили на прешпекте (так назывался проспект) кучера и официанты, с криком провезли его возки и сани к флигелю по нарочно засыпанной снегом дороге.
Князю Василью и Анатолю были отведены отдельные комнаты.
Анатоль сидел, сняв камзол и подпершись руками в бока, перед столом, на угол которого он, улыбаясь, пристально и рассеянно устремил свои прекрасные большие глаза. На всю жизнь свою он смотрел как на непрерывное увеселение, которое кто то такой почему то обязался устроить для него. Так же и теперь он смотрел на свою поездку к злому старику и к богатой уродливой наследнице. Всё это могло выйти, по его предположению, очень хорошо и забавно. А отчего же не жениться, коли она очень богата? Это никогда не мешает, думал Анатоль.
Он выбрился, надушился с тщательностью и щегольством, сделавшимися его привычкою, и с прирожденным ему добродушно победительным выражением, высоко неся красивую голову, вошел в комнату к отцу. Около князя Василья хлопотали его два камердинера, одевая его; он сам оживленно оглядывался вокруг себя и весело кивнул входившему сыну, как будто он говорил: «Так, таким мне тебя и надо!»
– Нет, без шуток, батюшка, она очень уродлива? А? – спросил он, как бы продолжая разговор, не раз веденный во время путешествия.
– Полно. Глупости! Главное дело – старайся быть почтителен и благоразумен с старым князем.
– Ежели он будет браниться, я уйду, – сказал Анатоль. – Я этих стариков терпеть не могу. А?
– Помни, что для тебя от этого зависит всё.
В это время в девичьей не только был известен приезд министра с сыном, но внешний вид их обоих был уже подробно описан. Княжна Марья сидела одна в своей комнате и тщетно пыталась преодолеть свое внутреннее волнение.
«Зачем они писали, зачем Лиза говорила мне про это? Ведь этого не может быть! – говорила она себе, взглядывая в зеркало. – Как я выйду в гостиную? Ежели бы он даже мне понравился, я бы не могла быть теперь с ним сама собою». Одна мысль о взгляде ее отца приводила ее в ужас.
Маленькая княгиня и m lle Bourienne получили уже все нужные сведения от горничной Маши о том, какой румяный, чернобровый красавец был министерский сын, и о том, как папенька их насилу ноги проволок на лестницу, а он, как орел, шагая по три ступеньки, пробежал зa ним. Получив эти сведения, маленькая княгиня с m lle Bourienne,еще из коридора слышные своими оживленно переговаривавшими голосами, вошли в комнату княжны.
– Ils sont arrives, Marieie, [Они приехали, Мари,] вы знаете? – сказала маленькая княгиня, переваливаясь своим животом и тяжело опускаясь на кресло.
Она уже не была в той блузе, в которой сидела поутру, а на ней было одно из лучших ее платьев; голова ее была тщательно убрана, и на лице ее было оживление, не скрывавшее, однако, опустившихся и помертвевших очертаний лица. В том наряде, в котором она бывала обыкновенно в обществах в Петербурге, еще заметнее было, как много она подурнела. На m lle Bourienne тоже появилось уже незаметно какое то усовершенствование наряда, которое придавало ее хорошенькому, свеженькому лицу еще более привлекательности.
– Eh bien, et vous restez comme vous etes, chere princesse? – заговорила она. – On va venir annoncer, que ces messieurs sont au salon; il faudra descendre, et vous ne faites pas un petit brin de toilette! [Ну, а вы остаетесь, в чем были, княжна? Сейчас придут сказать, что они вышли. Надо будет итти вниз, а вы хоть бы чуть чуть принарядились!]
Маленькая княгиня поднялась с кресла, позвонила горничную и поспешно и весело принялась придумывать наряд для княжны Марьи и приводить его в исполнение. Княжна Марья чувствовала себя оскорбленной в чувстве собственного достоинства тем, что приезд обещанного ей жениха волновал ее, и еще более она была оскорблена тем, что обе ее подруги и не предполагали, чтобы это могло быть иначе. Сказать им, как ей совестно было за себя и за них, это значило выдать свое волнение; кроме того отказаться от наряжения, которое предлагали ей, повело бы к продолжительным шуткам и настаиваниям. Она вспыхнула, прекрасные глаза ее потухли, лицо ее покрылось пятнами и с тем некрасивым выражением жертвы, чаще всего останавливающемся на ее лице, она отдалась во власть m lle Bourienne и Лизы. Обе женщины заботились совершенно искренно о том, чтобы сделать ее красивой. Она была так дурна, что ни одной из них не могла притти мысль о соперничестве с нею; поэтому они совершенно искренно, с тем наивным и твердым убеждением женщин, что наряд может сделать лицо красивым, принялись за ее одеванье.
– Нет, право, ma bonne amie, [мой добрый друг,] это платье нехорошо, – говорила Лиза, издалека боком взглядывая на княжну. – Вели подать, у тебя там есть масака. Право! Что ж, ведь это, может быть, судьба жизни решается. А это слишком светло, нехорошо, нет, нехорошо!
Нехорошо было не платье, но лицо и вся фигура княжны, но этого не чувствовали m lle Bourienne и маленькая княгиня; им все казалось, что ежели приложить голубую ленту к волосам, зачесанным кверху, и спустить голубой шарф с коричневого платья и т. п., то всё будет хорошо. Они забывали, что испуганное лицо и фигуру нельзя было изменить, и потому, как они ни видоизменяли раму и украшение этого лица, само лицо оставалось жалко и некрасиво. После двух или трех перемен, которым покорно подчинялась княжна Марья, в ту минуту, как она была зачесана кверху (прическа, совершенно изменявшая и портившая ее лицо), в голубом шарфе и масака нарядном платье, маленькая княгиня раза два обошла кругом нее, маленькой ручкой оправила тут складку платья, там подернула шарф и посмотрела, склонив голову, то с той, то с другой стороны.