Величину r в уравнении клапейрона менделеева называют. Уравнение менделеева клапейрона
Каждый школьник, учащийся в десятом классе, на одном из уроков физики изучает закон Клапейрона-Менделеева, его формулу, формулировку, учится применению при решении задач. В технических университетах эта тема тоже входит в курс лекций и практических работ, причем в нескольких дисциплинах, а не только на физике. Закон Клапейрона-Менделеева активно используется в термодинамике при составлении уравнений состояния идеально газа.
Термодинамика, термодинамические состояния и процессы
Термодинамика представляет собой раздел физики, который посвящен изучению общих свойств тел и тепловых явлений в этих телах без учета их молекулярного строения. Давление, объем и температура являются основными величинами, учитывающимися при описании тепловых процессов в телах. Термодинамическим процессом называется изменение состояния системы, т. е. изменение ее основных величин (давление, объем, температура). В зависимости от того, происходят ли изменения основных величин, системы бывают равновесными и неравновесными. Процессы тепловые (термодинамические) можно так классифицировать. То есть если система переходит из одного равновесного состояния в другое, то такие процессы называются, соответственно, равновесными. Неравновесные процессы, в свою очередь, характеризуются переходами неравновесных состояний, то есть основные величины претерпевают изменения. Однако можно их (процессы) разделить на обратимые (возможен обратный переход через те же состояния) и необратимые. Все состояния системы можно описать определенными уравнениями. Для упрощения расчетов в термодинамике вводится такое понятие, как идеальный газ - некая абстракция, которая характеризуется отсутствием взаимодействия на расстоянии между молекулами, размерами которых можно пренебречь ввиду их малого размера. Основные газовые законы и уравнение Менделеева-Клапейрона тесно взаимосвязаны - все законы вытекают из уравнения. Они описывают изопроцессы в системах, то есть такие процессы, в результате которых один из основных параметров остается неизменным (изохорный процесс - не изменяется объем, изотермический - постоянна температура, изобарный - происходит изменение температуры и объема при постоянстве давления). Закон Клапейрона-Менделеева стоит разобрать подробнее.

Уравнение состояния идеального газа
Закон Клапейрона-Менделеева выражает зависимость между давлением, объемом, температурой, количеством вещества именно идеального газа. Можно так же выразить зависимость только между основными параметрами, то есть абсолютной температурой, молярным объемом и давлением. Суть не изменяется, так как молярный объем равен отношению объема к количеству вещества.

Закон Менделеева-Клапейрона: формула
Уравнение состояния идеального газа записывается в виде произведения давления на молярный объем, приравненного к произведению универсальной газовой постоянной и абсолютной температуры. Универсальная газовая постоянная - коэффициент пропорциональности, константа (неизменная величина), выражающая работу расширения моля в процессе увеличения значения температуры на 1 Кельвин в условиях изобарного процесса. Ее величина составляет (приблизительно) 8,314 Дж/(моль*К). Если выразить молярный объем, то получится уравнение вида: р*V=(m/М)*R*Т. Или можно привести к виду: р=nkT, где n - концентрация атомов, к - постоянная Больцмана (R/N А).
Решение задач

Закон Менделеева-Клапейрона, решение задач с его помощью значительно облегчают расчетную часть при проектировании оборудования. Закон при решении задач применяется в двух случаях: задано одно состояние газа и его масса и при неизвестности величины массы газа известен факт ее изменения. Необходимо учитывать, что в случае многокомпонентных систем (смеси газов) записывается уравнение состояния для каждого компонента, т. е. для каждого газа в отдельности. Для установления связи между давлением смеси и давлениями компонентов используется закон Дальтона. Также стоит помнить, что для каждого состояния газа описывается отдельным уравнением, далее решается уже полученная система уравнений. И, наконец, необходимо всегда помнить, что в случае уравнения состояния идеального газа температура является абсолютной величиной, ее значение обязательно берется в Кельвинах. Если в условиях задачи температура измеряется в градусах Цельсия или в каких-либо других, то необходимо произвести перевод в градусы Кельвина.
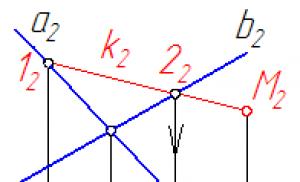
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р ,объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением: Рис.7.4.
F (p , V , T )=0,
где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля - Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V 1 , имеет давление р 1 и находится при температуре T 1 . Эта же масса газа в другом произвольном состоянии характеризуется параметрами р 2 , V 2 , Т 2 (рис.7.4).
Переход из состояния 1 в состояние 2осуществляется в виде двух процессов: 1) изотермического (изотерма 1 – 1 /), 2) изохорного (изохора 1 / – 2).
В соответствии с законами Бойля- Мариотта (7.1) и Гей-Люссака (7.5) запишем:
р 1 V 1 =p / 1 V 2 , (7.6)
. (7.7)
Исключив из уравнений (7.6) и (7.7) p / 1 получим:
 .
.
Так как состояния 1 и 2были выбраны произвольно, то для данной массы газа величина pV/T остается постоянной, т. е.
pV/T = В = const. (7.8)
Выражение (7.8) является уравнением Клапейрона , в котором В - газовая постоянная, различная для разных газов.
Д. И. Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (7.8) к одному молю, использовав молярный объем V m . Согласно закону Авогадро, при одинаковых p и Τ моли всех газов занимают одинаковый молярный объем V m ,поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной . Уравнению
pV m = RT (7.9)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа , называемым также уравнением Клапейрона - Менделеева .
Числовое значение молярной газовой постоянной определим из формулы (7.9), полагая, что моль газа находится при нормальных условиях (р 0 = 1,013×10 5 Па, T 0 =273,15 К, V m =22,41×10 -3 м 3 /моль): R =8,31 Дж/(моль К).
От уравнения (7.9) для моля газа можно перейти к уравнению Клапейрона - Менделеева для произвольной массы газа. Если при некоторых заданных p и T один моль газа занимает молярный объем V m , то масса т газа займет объем V= (m/М ) V m ,где Μ – молярная масса (масса одного моля вещества). Единица молярной массы – килограмм на моль (кг/моль). Уравнение Клапейрона - Менделеева для массы т газа
pV = RT = vRT ,(7.10)
где: v=m/M - количество вещества.
Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана
k=R/N A = 1,38∙10 -23 Дж/К.
Исходя из этого, уравнение состояния (2.4) запишем в виде
p= RT/V m = kN A T/V m = nkT ,
где N A /V m =n - концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
p=nkT (7.11)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1м 3 газа при нормальных условиях, называется числом Лошмидта:
N l = р 0 / (kТ 0)= 2,68∙10 25 м -3 .
Уравнение Менделеева Клапейрона берет свое начало от французского инженера Клапейрона Б. жившего с 1799 по 1864 годы. Так как у параметров состояния идеального газа есть связь, он соединил имеющиеся экспериментальные законы газов и выявил связь в параметрах.
pW/T = const
А Менделеев Д.И. наш русский ученый живший с 1834 по 1907 года, соединил его с законом Авогадро. Из данного закона следует что, если Р и Т одинаковы то моль какого бы ни было газа занимает равный молярный объем. Wm=22.4л. Из чего и следует вывод Менделеева - постоянное значение в правой части уравнения, одинаково для любого газа. Обозначение пишется как R, а называется - универсальная газовая постоянная.
Цифровое выражение R вычисляем путем подстановки. Уравнение Менделеева Клапейрона выглядит как:
PW = nRT
в нем:
Р
- газовое давление, W
- литровый объем, T
- температура, измеряется в кельвинах, n
- число молей, R
- УГП.
К примеру: Кислород находится в емкости на 2,6 литра, под давлением 2,3атм и 26 градусах С. Неизвестно сколько в емкости содержится молей О 2 ?
По закону газа находим сколько молей n
n = PW/RT из чего: n = (2.3 атм*2,6л)/(0,0821 л*атм/моль*К*299К) = 0,24 моль О 2
Температуру нужно обязательно переводить в кельвины (273 0 С + 26 0 С) = 299К. Во избежание ошибок при решении уравнений, надо обращать внимание на величины в которых даются данные для уравнения Менделеева-Клапейрона Давление может быть в мм рт.столба - переводим в атмосферы (1 атм = 760мм р/с). Если же в паскалях при переводе в атмосферы, важно помнить что 101325 Па = 1атм.
Если производить расчеты где единицы измерения в м 3 и Па. Здесь нужно использовать R = 8,314 Дж/К*моль (постоянная газовая).
Рассмотрим на примере:
Дано: Объем Гелия 16,5 литров, температура - 78 0 С, давление 45,6атм. Какой будет его объем в нормальных условиях? Количество молей? Мы можем быстро выяснить сколько молей n в нем содержится, с помощью Уравнения Менделеева-Клапейрона, но как быть если забылось значение R. В нормальных условиях 1 моль (1атм и 273К) заполняет 22,4 литра. То есть
PW = nRT, из этого следует, R = PW/nT = (1атм*22,4л)/(1 моль*273К) = 0,082
Если сделать так, что бы R сократилась. Получим следующий вариант решения.
Начальные данные: Р 1 = 45,6атм, W 1 = 16.5л, Т 1 =351К.
Конечные данные: Р 2 = 1атм, W 2 = ?, Т 2 =273К.
Мы видим что уравнение ровно справедливо и для исходных и для конечных данных
P 1 W 1 = nRT 1
P 2 W 2 = nRT 2
Для того чтобы узнать объем газа, поделим значения в уравнении
P 1 W 1 /P 2 W 2 = T 1 /T 2 ,
вставим известные нам значения
W 2 = 45.6 * 16.5 * 273 / 351 = 585 литров
Значит в нормальных условиях объем гелия будет 585 литров. Делим 585 на молярный газовый объем в норм. условиях (22,4 л/*моль) получим сколько молей в гелии 585 / 22,4 = 26,1м.
Заметка: Если у Вас проблемы связанные с прокладкой коммуникаций бестраншейным способом, зайдите по ссылке - прокол под газопровод (http://www.prokolgnb.ru) и узнайте как их решить.
Аннотация: традиционное изложение темы, дополненное демонстрацией на компьютерной модели.
Из трех агрегатных состояний вещества наиболее простым является газообразное состояние. В газах силы, действующие между молекулами, малы и при определенных условиях ими можно пренебречь.
Газ называется идеальным , если:
Можно пренебречь размерами молекул, т.е. можно считать молекулы материальными точками;
Можно пренебречь силами взаимодействия между молекулами (потенциальная энергия взаимодействия молекул много меньше их кинетической энергии);
Удары молекул друг с другом и со стенками сосуда можно считать абсолютно упругими.
Реальные газы близки по свойствам к идеальному при:
Условиях, близких к нормальным условиям (t = 0 0 C, p = 1.03·10 5 Па);
При высоких температурах.
Законы, которым подчиняется поведение идеальных газов, были открыты опытным путем достаточно давно. Так, закон Бойля - Мариотта установлен еще в 17 веке. Дадим формулировки этих законов.
Закон Бойля - Мариотта. Пусть газ находится в условиях, когда его температура поддерживается постоянной (такие условия называются изотермическими ).Тогда для данной массы газа произведение давления на объем есть величина постоянная:
Эту формулу называют уравнением изотермы . Графически зависимость p от V для различных температур изображена на рисунке.

Свойство тела изменять давление при изменении объема называется сжимаемостью . Если изменение объема происходит при T=const, то сжимаемость характеризуется изотермическим коэффициентом сжимаемости который определяется как относительное изменение объема, вызывающее изменение давления на единицу.

Для идеального газа легко вычислить его значение. Из уравнения изотермы получаем:

Знак минус указывает на то, что при увеличении объема давление уменьшается. Т.о., изотермический коэффициент сжимаемости идеального газа равен обратной величине его давления. С ростом давления он уменьшается, т.к. чем больше давление, тем меньше у газа возможностей для дальнейшего сжатия.
Закон Гей - Люссака. Пусть газ находится в условиях, когда постоянным поддерживается его давление (такие условия называются изобарическими ). Их можно осуществить, если поместить газ в цилиндр, закрытый подвижным поршнем. Тогда изменение температуры газа приведет к перемещению поршня и изменению объема. Давление же газа останется постоянным. При этом для данной массы газа его объем будет пропорционален температуре:
![]()
где V 0 - объем при температуре t = 0 0 C, - коэффициент объемного расширения газов. Его можно представить в виде, аналогичном коэффициенту сжимаемости:

Графически зависимость V от T для различных давлений изображена на рисунке.

Перейдя от температуры в шкале Цельсия к абсолютной температуре , закон Гей - Люссака можно записать в виде:
Закон Шарля. Если газ находится в условиях, когда постоянным остается его объем (изохорические условия), то для данной массы газа давление будет пропорционально температуре:
![]()
где р 0 - давление при температуре t = 0 0 C, - коэффициент давления . Он показывает относительное увеличение давления газа при нагревании его на 1 0:

Закон Шарля также можно записать в виде:
Закон Авогадро: один моль любого идеального газа при одинаковых температуре и давлении занимает одинаковый объем. При нормальных условиях (t = 0 0 C, p = 1.03·10 5 Па) этот объем равен м -3 /моль.
Число частиц, содержащихся в 1 моле различных веществ, наз. постоянная Авогадро :
Легко вычислить и число n 0 частиц в 1 м 3 при нормальных условиях:

Это число называется числом Лошмидта .
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е.
где - парциальные давления - давления, которые бы оказывали компоненты смеси, если бы каждый из них занимал объем, равный объему смеси при той же температуре.
Уравнение Клапейрона - Менделеева. Из законов идеального газа можно получить уравнение состояния , связывающее Т, р и V идеального газа в состоянии равновесия. Это уравнение впервые было получено французским физиком и инженером Б. Клапейроном и российским учеными Д.И. Менделеевым, поэтому носит их имя.
Пусть некоторая масса газа занимает объем V 1 , имеет давление p 1 и находится при температуре Т 1 . Эта же масса газа в другом состоянии характеризуется параметрами V 2 , p 2 , Т 2 (см. рисунок). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: изотермического (1 - 1") и изохорического (1" - 2).

Для данных процессов можно записать законы Бойля - Мариотта и Гей - Люссака:
Исключив из уравнений p 1 " , получим
Так как состояния 1 и 2 были выбраны произвольно, то последнее уравнение можно записать в виде:
![]()
Это уравнение называется уравнением Клапейрона , в котором В - постоянная, различная для различных масс газов.
Менделеев объединил уравнение Клапейрона с законом Авогадро. Согласно закону Авогадро, 1 моль любого идеального газа при одинаковых p и T занимает один и тот же объем V m , поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется универсальной газовой постоянной . Тогда
Это уравнение и является уравнением состояния идеального газа , которое также носит название уравнение Клапейрона - Менделеева .
Числовое значение универсальной газовой постоянной можно определить, подставив в уравнение Клапейрона - Менделеева значения p, T и V m при нормальных условиях:
Уравнение Клапейрона - Менделеева можно записать для любой массы газа. Для этого вспомним, что объем газа массы m связан с объемом одного моля формулой V=(m/M)V m , где М - молярная масса газа . Тогда уравнение Клапейрона - Менделеева для газа массой m будет иметь вид:
![]()
где - число молей.
Часто уравнение состояния идеального газа записывают через постоянную Больцмана:
![]()
Исходя из этого, уравнение состояния можно представить как
![]()
где - концентрация молекул. Из последнего уравнения видно, что давление идеального газа прямо пропорционально его температуре и концентрации молекул.
Небольшая демонстрация законов идеального газа. После нажатие кнопки "Начнем" Вы увидите комментарии ведущего к происходящему на экране (черный цвет) и описание действий компьютера после нажатия Вами кнопки "Далее" (коричневый цвет). Когда компьютер "занят" (т.е. идет опыт) эта кнопка не активна. Переходите к следующему кадру, лишь осмыслив результат, полученный в текущем опыте. (Если Ваше восприятие не совпадает с комментариями ведущего, напишите!)
Вы можете убедиться в справедливости законов идеального газа на имеющейся
Оно выведено на основе объединенного закона Бойля-Мариотта и Гей-Люссака с применением закона Авогадро. Для одной грамм-молекулы любого вещества, находящегося в идеальном газовом состоянии, уравнение Менделеева-Клапейрона имеет выражение:
Или PV = RT (11) .
В том случае, если имеется не один, а n молей газа выражение принимает вид:
где R- универсальная газовая постоянная, не зависящая от природы газа.
Так как число грамм-молей газа , где m- масса газа, а М- его молекулярная масса, то выражение (12) принимает вид:
Числовое значение R зависит от единицы измерения давления и объема. Величина ее выражается в единицах энергия/моль´град. Для нахождения числовых значений R используем уравнение (11), применив его для 1 моля идеального газа, находящегося в нормальных условиях,
Подставив в уравнение (11) числовые значения Р=1 атм, T= 273° и V = 22,4 л, получаем
В международной системе единиц СИ давление выражается в ньютонах на м 2 (н/м 2), а объем в м 3 . Тогда .
Пользуясь уравнением Менделеева-Клапейрона можно производить следующие расчеты: а) нахождение физических параметров состояния газа по его молекулярной массе и другим данным, б) нахождение молекулярной массы газа по данным о его физическом состоянии (см. пример 22).
Пример 11. Сколько весит азот, находящийся в газгольдере диаметром 3,6 м и высотой 25 м при температуре 25ºС и давлении 747 мм рт. ст.?
IIример 12. В колбе емкостью 500 мл при 25ºС находится 0,615 г оксида азота (II). Каково давление газа в атмосферах, в н/м 2 ?
Пример 13. Масса колбы емкостью 750 см 3 , наполненной кислородом при 27°С, равна 83,35 г. Масса пустой колбы 82,11 г. Определить давление кислорода и мм рт.ст. на стенки колбы.
Закон Дальтона
Сформулирован этот закон так: общее давление смесей газов, не реагирующих друг с другом, равно сумме парциальных давлении составных частей (компонентов).
P = p 1 + p 2 + p 3 + ….. + p n (14)
где Р - общее давление смеси газов; p 1 , p 2 , p 3 , …., p n – парциальные давления компонентов смеси.
Парциальным давлением называется давление, оказываемое каждым компонентом газовой смеси, если представить этот компонент занимающим объем, равный объему смеси при той же температуре. Иными словами, парциальным давлением называется та часть общего давления газовой смеси, которая обусловлена данным газом.
Из закона Дальтона следует, что при наличии смеси газов п в уравнении (12) представляет собой сумму числа молей всех компонентов, образующих данную смесь, а Р- общее давление смеси, занимающей при температуре Т объем V.
Зависимость между парциальными давлениями и общим выражается уравнениями:
где n 1 , n 2 , n 3 - число молей компонента 1, 2, 3, соответственно, в смеси газов.
Отношения называются мольными долями данного компонента.
Если мольную долю обозначить через N, то парциальное давление любого i-го компонента смеси (где i = 1,2,3,...) будет равно:
Таким образом, парциальное давление каждого компонента смеси равно произведению его мольной доли па общее давление газовой смеси.
Помимо парциального давления у газовых смесей различают парциальный объем каждого из газов v 1 , v 2 , v 3 и т. д.
Парциальным называют объем, который занимал бы отдельный идеальный газ, входящий в состав идеальной смеси газов, если бы при том же количестве, он имел давление и температуру смеси.
Сумма парциальных объемов всех компонентов газовой смеси равна общему объему смеси
V = v 1 , + v 2 + v 3 + ... + v n (16) .
Отношение и т. д. называется объемной долей первого, второго и т.д. компонентов газовой смеси. Для идеальных газов мольная доля равна объемной доле. Следовательно, парциальное давление каждого компонента смеси равно также произведению его объемной доли на общее давление смеси.
; ; p i = r i ´P (17).
Парциальное давление обычно находят из величины общего давления с учетом состава газовой смеси. Состав газовой смеси выражают в весовых процентах, объемных процентах и в мольных процентах.
Объемным процентом называется объемная доля, увеличенная в 100 раз (число единиц объема данного газа, содержащегося в 100 единицах объема смеси)
Мольным процентом q называется мольная доля, увеличенная в 100 раз.
Весовой процент данного газа - число единиц массы его, содержащихся в 100 единицах массы газовой смеси.
где m 1 , m 2 – массы отдельных компонентой газовой смеси; m – общая масса смеси.
Для перехода от объемных процентов к весовым, что бывает необходимым в практических расчетах, пользуются формулой:
где r i (%) - объемное процентное содержание i-гo компонента газовой смеси; M i -молекулярная масса этого газа; М ср - средняя молекулярная масса смеси газов, которую вычисляют по формуле
М ср = М 1 ´r 1 + M 2 ´r 2 + M 3 ´r 3 + ….. + M i ´r i (19)
где М 1 , M 2 , M 3 , M i - молекулярные мaccы отдельных газов.
Если состав газовой смеси выражен количеством масс отдельных компонентов, то среднюю молекулярную массу смеси можно выразить по формуле
где G 1 , G 2 , G 3 , G i – доли масс газов в смеси: ; ; и т.д.
Пример 14. 5 л азота под давлением 2 атм, 2 л кислорода под давлением 2,5 атм и 3 л углекислою газа под давлением 5 атм перемешаны, причем объем, предоставленный смеси, равен 15 л. Вычислить, под каким давлением находятся смесь и парциальные давления каждого газа.
Азот, занимавший объем 5 л при давлении Р 1 = 2 атм, после смешения с другими газами распространился в объеме V 2 = 15 л. Парциальное давление азота р N 2 = Р 2 находим из закона Бойля-Мариотта (P 1 V 1 = P 2 V 2). Откуда
Парциальное давления кислорода и углекислого газа находим аналогичным способом:
Общее давление смеси равно .
Пример 15. Смесь, состоящая из 2 молей водорода, некоторого количества молей кислорода и 1 моля азота при 20°С и давлении 4 атм, занимает объем 40 литров. Вычислить число молей кислорода в смеси и парциальные давления каждого из газов.
Из уравнения (12) Менделеева-Клапейрона находим общее число молей всех газов, составляющих смесь
Число молей кислорода в смеси равно
Парциальные давления каждого из газов вычисляем по уравнениям (15а):
Пример 17. Состав паров бензольных углеводородов над поглотительным маслом в бензольных скрубберах, выраженный в единицах массы, характеризуется такими величинами: бензола C 6 H 6 - 73%, толуола С 6 Н 5 СН 3 - 21%, ксилола С 6 Н 4 (СН 3) 2 - 4%, триметилбензола С 6 Н 3 (СН 3) 3 - 2%. Вычислить содержание каждой составной части по объему и парциальные давления паров каждого вещества, если общее давление смеси равно 200 мм рт. ст.
Для вычисления содержания каждой составной части смеси паров по объему используем формулу (18)
Следовательно, необходимо знать М ср, которую можно вычислить из формулы (20):
Парциальные давления каждого компонента в смеси вычисляем, используя уравнение (17)
p бензола = 0,7678´200 = 153,56 мм рт.ст. ; p толуола = 0,1875´200 = 37,50 мм рт.ст. ;
p ксилола = 0,0310´200 = 6,20 мм рт.ст. ; p триметилбензола = 0,0137´200 = 2,74 мм рт.ст.
Похожая информация.